花王は、理化学研究所と北里大学と共同で、明るく極めて褪色しにくい蛍光タンパク質「StayGold」を開発し、生細胞で細胞小器官の微細構造の動態を速く長く解析する定量的観察法を確立した。また、StayGoldとVHH抗体の融合タンパク質を作製し、固定感染細胞における新型コロナウイルスのスパイクタンパク質の詳細な分布を明らかにした。
研究成果は、褪色による制限を取り払うことで、蛍光観察の時空間の幅を飛躍的に拡張し、定量性を求める創薬開発研究に貢献することが期待される。
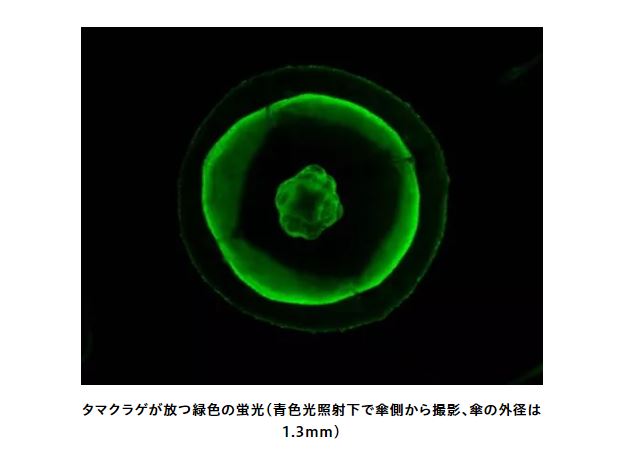
今回、共同研究グループは、「タマクラゲ」の遺伝子発現解析データをもとに、野生型タマクラゲの緑色蛍光タンパク質を遺伝子クローニングし、明るく極めて褪色しにくい変異体StayGoldを創出した。
小胞体、ミトコンドリア、微小管などの細胞小器官をStayGoldで蛍光標識し、従来の蛍光タンパク質では褪色のために解析できなかった動的構造変化を明らかにした。また、StayGoldを抗SARS-CoV-2スパイクタンパク質VHH抗体に連結することで、感染細胞内でウイルス粒子が成熟する経路を捉えることに成功した。
近年、オワンクラゲやナメクジウオ、サンゴ、イソギンチャクに由来する蛍光タンパク質で細胞内の小胞体やミトコンドリアなどの細胞小器官を蛍光標識し、生理的条件下で細胞小器官の挙動を鮮明に観察することが可能になっているが、蛍光タンパク質は、励起のための光を増強させると褪色し、そのシグナルが減弱・消滅するという欠点がある。蛍光タンパク質の褪色によりバイオイメージングの性能の幅が制限される状況にあり、褪色しにくい実用的な蛍光タンパク質を開発することが重要課題として掲げられてきた。
しかし、蛍光タンパク質技術の開発者は、光安定性を追求すると暗くなり、逆に明るさを追求すると褪色しやすくなるといった具合に、光安定性と明るさとの間にあるトレードオフに悩まされてきた。これまで、明るさを追求すべく数多くの蛍光タンパク質変異体が開発されてきたが、それらはほぼ全て光安定性を犠牲にしたものだった。
共同研究グループはトランスクリプトーム解析の結果を基に、タマクラゲから新しい緑色蛍光タンパク質CU17Sの遺伝子をクローニングすることに成功した。CU17S遺伝子を大腸菌やヒト由来の培養細胞に導入したところ、非常に暗い緑色の蛍光を確認でき、さらにCU17Sの褪色しにくい特性を察知した。
そこで、CUS17Sにランダム変異を導入したところ、非常に明るく極めて光安定性の高い変異体を作製することに成功し、この変異体を「StayGold」と命名した。明るさを考慮して、光安定性を絶対的褪色定量法により定量評価したところ、StayGoldは既存の蛍光タンパク質と比べて10~100倍優れていることがわかった。
次に、StayGoldを使って培養細胞の小胞体を蛍光標識し、連続的な照明の下、経時的な蛍光観察を行った結果、細胞全体にわたる広い視野で長時間の高速観察ができることを確認した。実際、スピニングディスク型の共焦点顕微鏡を用いた観察を100秒間行ったところ、緑色蛍光タンパク質(GFP)の蛍光強度は半分以下になるのに対し、StayGoldはほとんど褪色しないことがわかった。
共同研究グループは、StayGoldを使ってさまざまな細胞小器官の動態観察を試みた結果、小胞体の細管網目構造の動きがカルシウムイオンによって緩和される様子が確認された。また、新型コロナウイルス(SARS-CoV-2)を対象とするStayGoldの応用研究を試みた。一般的に、ウイルス構造タンパク質に対する抗体をベースにした抗原検査は低感度性が問題点として指摘されているが、StayGoldの明るさと光安定性を活用すれば高感度を達成できると考えた。
SARS-CoV-2が感染した固定処理済みのVero細胞(アフリカミドリザル腎由来細胞)を蛍光VHH抗体で処理しSIM観察を行ったところ、スパイクタンパク質がたまるとされる小胞構造の分布を高精細かつ包括的に解析することができた。z軸方向に焦点をずらしながら断層画像を取得し、ある3次元空間内の蛍光シグナルを再構成する体積イメージングにおいても、StayGoldの高い光安定性が定量的な観測を可能にすることを確認した。
定量性を目指す蛍光イメージングにおいて色素の褪色は常に障害となり、経時的な観察やzスキャンを伴う体積イメージングでは、サンプルに繰り返し光を照射することが必須なため、多かれ少なかれ褪色問題が発生するが、今回開発した蛍光タンパク質「StayGold」は二量体であってもそのまま単独で発現させることができるため、薬効評価など定量性を重視する分野で、直ちに活用されることが期待できる。

この記事は粧業日報 2022年5月10日号 4ページ 掲載
■薬王堂HD、スタートアップとのコラボで新規事業を育成~肌診断、健康診断などのピックアップデータを解析し店頭へ送客◎22年2月期、新店費用増、利益率低下で増収減益■スギHD、コロナ関連特需の反動や販管費の負担増で増収減益■花王、細胞微細構造やウイルスを定量的に観察できる技術を開発■大日本印刷、紙仕様のラミネートチューブが資生堂製品で初採用
PDF記事・人気ランキング

バラ売り
400円
【週刊粧業】2024年下期オーラルケアの最新動向

バラ売り
400円
【週刊粧業】2024年パーソナライズドコスメの最新動向

バラ売り
400円
【週刊粧業】2024年ヘアケアの最新動向

バラ売り
400円
【週刊粧業】シンクタンクが分析する2025年国内化粧品市場
最新PDF記事

バラ売り
300円
【週刊粧業】2024年アジアンコスメの最新動向

バラ売り
200円
【週刊粧業】ビズジーン、遺伝子検査技術を様々な分野に活かす

バラ売り
200円
【週刊粧業】Zenken、人材獲得と企業ブランディングを両立したサービスが好調

バラ売り
200円
【週刊粧業】2024年・年末大掃除の最新動向
人気記事ランキング
日用品メーカー
人気記事ランキング
ライブラリ・無料
ダウンロードコーナー

PDF版 ダウンロード販売
気になる刊行物をPDFで
ダウンロード
紙面を探す

化粧品
マーケティング情報
マーケティングに役立つ
情報が満載
紙面を探す

調査レポート
化粧品業界での戦略に
役立つレポート
レポートを探す

粧界データ集
メーカー製品一覧などの
データ集をダウンロード
無料でダウンロード

化粧品容器カタログ
ライブラリー
容器メーカーの
最新カタログを公開中
カタログを探す

デジタル紙面版
2010年1月から最新号まで
デジタルアーカイブ化
無料で見る
刊行物紹介

週刊/毎週月曜日発行
週刊粧業
化粧品、日用品、医薬品、美容業、装粧品、エステティック等を中心とした生産・流通産業界の総合専門情報紙。

季刊/年4回
C&T
化粧品、日用品、アクセサリーなどの業界別の市場動向をはじめ、戦略、流通、経営、マーケティングを扱う情報専門誌。

週刊/毎週月曜日発行
粧業日報
化粧品、トイレタリー、石鹸、歯磨、日用品に関する情報の速報版。業界のエグゼクティブ必読の情報紙。

週刊/毎週月曜日発行
訪販ジャーナル
昭和33年に創刊された、わが国初の訪問販売化粧品業界の専門情報紙。
更新情報(PR)
速報ニュース
アクセスランキング
- 日間
- 週間
- 月間